
Vaccination Covid-19 : recommandations de l’HAS
L’HAS publie ses recommandations concernant la stratégie de vaccination contre la Covid-19 à l’automne 2022.
Les recommandations émises par l’HAS sont à destination des pouvoirs publics. Elles sont basées sur l’approche proposée par l’OMS et formulent 3 scénarios possibles en fonction de la circulation du virus.
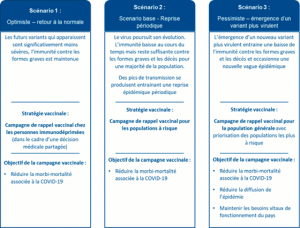
Afin d’anticiper la préparation d’une campagne vaccinale à l’automne prochain, la HAS recommande de considérer le scénario 2 caractérisé par la survenue de reprises épidémiques périodiques, comme le plus probable. Pour des raisons de mobilisation et de logistique, la HAS recommande de coupler la campagne de vaccination à celle de la grippe.
Toutefois, compte tenu du caractère imprévisible de l’apparition de nouveaux variants plus sévères, la HAS recommande néanmoins de ne pas exclure la possibilité d’un scénario plus pessimiste, bien que moins probable, et, d’anticiper la nécessité d’une campagne de vaccination à plus large échelle, en population générale, en capitalisant sur les expériences acquises lors de la campagne de primovaccination contre la Covid-19.
La HAS initiera l’évaluation médico-technique des nouveaux vaccins (notamment bivalents et nouvelles plateformes vaccinales) contre la Covid-19 au plus vite dès leur obtention de l’AMM.
Au regard des données d’efficacité vaccinale contre les formes sévères et les décès, contre les infections symptomatiques et contre les formes asymptomatiques de la maladie (efficacité contre la transmission), la HAS évaluera :
– La pertinence de vacciner les professionnels de santé et ceux exerçant dans les établissements accueillant des personnes âgées dans le scénario 2 ;
– La nécessité de vacciner l’entourage de personnes à risque dans le scénario 2.
Source : HAS


