Le 27 novembre 2025, la Commission européenne a publié la très attendue Décision (UE) 2025/2371. En une phrase : les modules « Acteurs », « UDI/Dispositifs », « Organismes notifiés & Certificats » et « Surveillance du marché » de la base de données européenne EUDAMED sont désormais considérés comme pleinement fonctionnels et conformes aux spécifications du règlement (UE) 2017/745 (MDR).
Que change concrètement cette décision ?
Jusqu’à présent, l’utilisation de ces modules restait volontaire tant que l’ensemble de la base de données n’était pas déclaré opérationnel. La nouvelle décision met fin à cette période de transition pour les quatre modules concernés.
À compter du 28 mai 2026 (six mois après la publication), leur utilisation deviendra obligatoire dans les cas suivants :
- Tout nouvel acteur économique (fabricant, mandataire, importateur, etc.) basé dans l’UE ou désignant un représentant dans l’UE devra s’enregistrer via le module Acteurs avant de pouvoir opérer.
- Tout nouveau dispositif (quelle que soit sa classe) destiné à être mis sur le marché dans l’UE devra figurer dans le module UDI/Devices avant sa première mise sur le marché.
- Les organismes notifiés (ONs) devront immédiatement enregistrer tout nouveau certificat MDR/IVDR (y compris les modifications) dans le module Certificats.
Ainsi, à partir du 28 mai 2026, les systèmes nationaux de registre devront céder la place à EUDAMED comme source unique et officielle pour ces quatre domaines.
Délais supplémentaires ?
Pour éviter toute perturbation des chaînes d’approvisionnement, la Commission a prévu des délais transitoires spécifiques pour les dispositifs et certificats « legacy » déjà présents sur le marché.
Selon le Gradual roll out of EUDAMED de November 2024 :
- Les dispositifs soumis à l’obligation d’enregistrement dans EUDAMED et déjà présents sur le marché avant le 28 mai 2026 devront être enregistrés dans EUDAMED au plus tard le 28 novembre 2026.
- Les certificats MDR/IVDR délivrés avant le 28 mai 2026 devront être chargés dans le module Certificats au plus tard le 28 mai 2027 (délai de 18 mois). C’est la responsabilité des organismes notifiés, mais nous recommandons fortement aux fabricants de vérifier que cela a bien été fait.
Nb : Cela ne s’applique qu’aux dispositifs qui doivent être ou sont enregistrés dans le module UDI/DEV.
Pour Rappel !
Les distributeurs ne sont pas tenus de s’enregistrer dans EUDAMED. Toutefois, cette absence d’obligation au niveau européen n’exclut pas des exigences locales : certains États membres peuvent imposer un enregistrement national aux distributeurs opérant sur leur territoire.
Dispositifs « legacy », « old » … attention aux exceptions & règles particulières :
- Les Dispositifs « legacy » et dispositifs conformes MDR/IVDR, s’ils ne sont plus mis sur le marché au moment où le module devient obligatoire. Sauf en cas d’action vigilance dans le cadre de la surveillance après commercialisation.
- Les Dispositifs « legacy » dit “identiques” à un dispositif conforme MDR/IVDR déjà enregistré. Sauf si le dispositif a subi des changements impliquant un nouvel IUD-ID,
- Les Dispositifs “old” au sens des MDCG 2021-25 et MDCG 2022-8 ne peuvent pas être enregistrés dans le module UDI/DEV . En cas d’incident grave ou FSCA, le fabricant devra fournir un jeu de données limité via le module Vigilance.
- Les Dispositifs sur mesure, ne peuvent pas être enregistrés dans le module UDI/DEV. En cas de MIR ou FSCA, un jeu de données limité doit être soumis dans le module Vigilance.
Nos recommandations pratiques
- Vérifiez dès maintenant que votre organisation possède un Single Registration Number (SRN). Si ce n’est pas le cas, lancez la procédure sans attendre.
- Formez vos équipes RA/QA à l’utilisation réelle des quatre modules (les sandbox et webinaires de la Commission sont excellents pour cela).
- Mettez à jour vos procédures internes d’enregistrement UDI et de gestion des certificats pour intégrer le chargement immédiat dans EUDAMED.
- Anticipez le volume : Il est à prévoir une charge importante à partir de mai 2026.
Ce qu’il reste à venir — Modules non encore obligatoires
Les modules « Investigations cliniques » et « Vigilance » ne sont pas encore concernés par l’obligation d’utilisation. Leur entrée en service obligatoire interviendra ultérieurement, une fois qu’ils auront, à leur tour, réussi l’audit indépendant requis.
L’audit du module Vigilance est prévu pour le 2ᵉ trimestre 2026, avec une publication possible au 4ᵉ trimestre 2026, sous réserve d’un résultat d’audit satisfaisant.
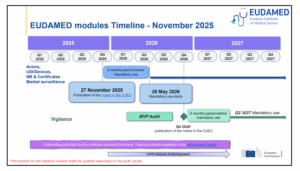
Calendrier d’Eudamed (01/12/2025)
En résumé, cette décision n’est pas une surprise, mais elle officialise le calendrier que beaucoup attendaient. Le compte à rebours est lancé : plus que six mois pour être parfaitement prêt.
En bonus, voici un tableau clair et synthétique récapitulant les dates et informations importantes liées au déploiement obligatoire d’EUDAMED :
|
Publication : 27 novembre 2025 |
Au plus tard 6 M après publication | Au plus tard 12 M après publication | Au plus tard 18 M après publication |
| Fin de la transition | 28 mai 2026 | 28 novembre 2026 | 28 mai 2027 |
| Module acteur | Les opérateurs économiques doivent s’enregistrer | – | – |
|
Module UDI / DM |
Obligation pour les fabricants d’enregistrer les dispositifs avant mise sur le marché. | Obligation pour les fabricants d’enregistrer les dispositifs mis sur le marché avant le 28 mai 2026 | – |
|
Module ON & Certificats |
Obligation pour les ONs d’enregistrer les nouveaux certificats MDR/IVDR (y compris les modifications) | – | Obligation pour les ONs d’enregistrer les certificats MDR/IVDR avant le 28 mai 2026, |
Source : Health Ec Europa


